1. számú feladat
Ha az alumíniumot nátrium-hidroxiddal olvasztják,
- 1. NaAlO 2
- 2 AlH3
- 3. Na
- 4 Al 2 O 3
Válasz: 1
Magyarázat:
Amikor alumíniumot lúggal olvasztunk, a NaOH a reakciónak megfelelően nátrium-aluminátot képez (a reakció hőmérséklete ~ 400˚C):
2(NaOH. H 2 O) + 2Al \u003d 2NaAlO 2 + H 2
Az alumínium lúgos oldatokkal reagálva tetrahidroxoaluminátokat képez:
2Al + 2NaOH + 6H 2 O \u003d 2Na + H 2
2. számú feladat
Vízzel at szobahőmérséklet reagál:
1) bárium és réz
2) alumínium és higany
3) kalcium és lítium
4) ezüst és nátrium
Válasz: 3
Magyarázat:
Csak az I. és II. csoport fő alcsoportjaiba tartozó fémek (a magnézium és a berillium kivételével) reagálnak a vízzel szobahőmérsékleten:
2Li + 2H 2O \u003d 2LiOH + H2
2Na + 2H 2O \u003d 2NaOH + H2
Ca + 2H 2 O \u003d Ca (OH) 2 + H 2
Ba + 2H 2 O \u003d Ba (OH) 2 + H 2
Az I. és II. csoportba tartozó Ag, Cu, Hg alcsoportok elemei nem lépnek kölcsönhatásba a vízzel.
Az Al normál körülmények között meglehetősen inert, mivel Al 2 O 3 oxid védőfóliával van borítva. Az oxidréteg eltávolítása után (mechanikusan vagy amalgamálással) az alumínium reakcióba lép vízzel:
2Al + 6H 2 O \u003d 2Al (OH) 3 ↓ + 2H 2
3. számú feladat
Csak oxidáló tulajdonságok mutatkozhatnak
1) Oxigén
Válasz: 2
Magyarázat:
A felsorolt nemfémek közül a fluor a legerősebb oxidálószer, amely az összes elem közül a legnagyobb elektronegativitással rendelkezik. A nem fémes oxigén valamivel gyengébb oxidáló tulajdonságokkal rendelkezik, azonban fluorral (OF 2) kombinálva az oxigén pozitív oxidációs állapotú, ezáltal redukáló tulajdonságokat mutat. A nitrogén és a klór, amelyek kevésbé elektronegatívak, oxidáló és redukáló tulajdonságokat is képesek felmutatni.
4. számú feladat
101435között lehetséges a reakció
- 1. Ag és K 2 SO 4 (oldat)
- 2. Zn és KCl (oldat)
- 3. Mg és SnCl 2 (oldat)
- 4. Ag és CuSO 4 (oldat)
Válasz: 3
Magyarázat:
Ahhoz, hogy a fém és a sóoldat közötti szubsztitúciós reakció gyakorlatilag megvalósítható legyen, a következő feltételnek kell teljesülnie: a fémnek a só részét képező fémtől balra lévő fémaktivitás-sorban kell elhelyezkednie.
Ezért az ezüst Ag nem lép reakcióba sem kálium-szulfát K 2 SO 4 oldatával, sem réz-szulfát CuSO 4 oldatával, a cink-Zn sem reagál a KCl kálium-kloriddal.
Gyakorlatilag megvalósítható reakció a magnézium és ón-klorid oldat között (a magnézium az óntól balra található:
Mg + SnCl 2 (oldat) = MgCl 2 + Sn.
5. számú feladat
A réz és a vas közös tulajdonsága, hogy képesek feloldódni
2) kénsav (oldat)
3) lúgos oldat
4) salétromsav (tömény)
Válasz: 4
Magyarázat:
A réz és a vas közös tulajdonsága, hogy hevítés közben tömény salétromsavban oldódnak:
Cu + 4HNO 3 (tömény) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
Fe + 6HNO 3 (tömény) \u003d Fe (NO 3) 3 + 3NO 2 + 3H 2 O (hevítve)
A forró vas reagál a vízgőzzel, a réz nem reagál:
3Fe + 4H 2 O \u003d Fe 3 O 4 + 4H 2
A réz a hidrogén után a fémaktivitás tartományába tartozik, ezért kevésbé aktív fémként nem képes kiszorítani a hidrogént a nem oxidáló savakból (kivéve a tömény HNO 3 és tömény H 2 SO 4)
A réz nem lép reakcióba hígított kénsavval.
A vas a fémek és a hidrogén aktivitási tartományában található, ezért kölcsönhatásba lép a sósav és a kénsav híg oldataival, és megfelelő sókat képez:
Fe + H 2 SO 4 (diff.) \u003d FeSO 4 + H 2
30%-os lúgos oldat vasanódon történő elektrolízisével ferrátok nyerhetők - a vassav H 2 FeO 4 sói, amelyek nem léteznek szabad formában
Fe + 2KOH + 2H 2 O → K 2 FeO 4 + 3H 2
A réz, mint átmeneti fém, nem lép kölcsönhatásba lúgokkal.
6. számú feladat
A klór a két anyag mindegyikével reagál:
- 1. O 2 és Ne
- 2. Fe és NaI
- 3. N 2 és Ő
- 4. NaF és O2
Válasz: 2
Magyarázat:
A klór (Cl 2) nem fém (erős oxidálószer), ezért fémekkel kölcsönhatásba lépve sókat - kloridokat képezhet:
2Fe + 3Cl 2 = 2FeCl 3 (A Fe Fe +3-ra oxidálódik)
A klór nagyobb elektronegativitással rendelkezik, mint a jód és bróm halogének, ezért erősebb oxidálószerként képes kiszorítani sóikból a brómot és a jódot:
2NaI + Cl 2 \u003d 2NaCl + I 2 ↓
Oxigénnel a klór képes oxidokat képezni, amelyekben +1 és +7 közötti oxidációs állapotot mutat: Cl 2 O, ClO 2, Cl 2 O 5 és Cl 2 O 7. Termikusan és fotokémiailag instabilak.
Fémfluoridokkal (NaF) a reakció nem megy végbe, mivel a fluor, mint a legerősebb oxidálószer, nem redukálható klórral.
A klór nem lép reakcióba nemesgázokkal (He, Ne) és kémiailag inert nitrogénnel (N 2).
MEGHATÁROZÁS
Klór- a kémiai elemek periódusos rendszerének 3. periódusának VII. csoportjába tartozó kémiai elem D.I. Mengyelejev. Nem fém.
Elemekre vonatkozik - p -család. Halogén. A sorozatszám 17. A külső elektronikus vízmérték felépítése 3s 2 3 p 5. Relatív atomtömeg - 35,5 am.u. A klórmolekula kétatomos - Cl 2.
A klór kémiai tulajdonságai
A klór reakcióba lép egyszerű fémekkel:
Cl 2 + 2Sb = 2SbCl 3 (t);
Cl 2 + 2Fe \u003d 2FeCl 3;
Cl 2 + 2Na = 2NaCl.
A klór kölcsönhatásba lép egyszerű nemfémes anyagokkal. Tehát a foszforral és a kénnel való kölcsönhatás során a megfelelő kloridok képződnek fluor-fluoridokkal, hidrogénnel - hidrogén-kloriddal, oxigénnel - oxidokkal stb.:
5Cl 2 + 2P = 2HCl 5;
Cl 2 + 2S \u003d SCl 2;
Cl 2 + H 2 \u003d 2HCl;
Cl 2 + F 2 \u003d 2ClF.
A klór képes kiszorítani a brómot és a jódot hidrogénnel és fémekkel alkotott vegyületeiből:
Cl2+2HBr=Br2+2HCl;
Cl 2 + 2NaI \u003d I 2 + 2NaCl.
A klór képes feloldódni vízben és lúgokban, miközben a klór diszproporcionálási reakciói lépnek fel, és a reakciótermékek összetétele a megvalósítás feltételeitől függ:
Cl 2 + H 2 O ↔ HCl + HClO;
Cl 2 + 2NaOH \u003d NaCl + NaClO + H 2 O;
3Cl 2 + 6NaOH \u003d 5NaCl + NaClO 3 + 3H 2 O.
A klór kölcsönhatásba lép egy nem sóképző oxiddal - CO-val, és triviális nevű anyagot képez - foszgént, az ammóniával pedig ammónium-trikloridot képez:
Cl 2 + CO \u003d COCl 2;
3 Cl 2 + 4NH 3 \u003d NCl 3 + 3NH 4 Cl.
A reakciókban a klór oxidálószer tulajdonságait mutatja:
Cl 2 + H 2 S \u003d 2HCl + S.
A klór kölcsönhatásba lép az alkánok, alkének és arének osztályába tartozó szerves anyagokkal:
CH 3 -CH 3 + Cl 2 = CH 3 -CH 2 -Cl + HCl (feltétel - UV sugárzás);
CH 2 = CH 2 + Cl 2 = CH 2 (Cl) -CH 2 -Cl;
C 6 H 6 + Cl 2 \u003d C 6 H 5 -Cl + HCl (kat = FeCl 3, AlCl 3);
C 6 H 6 + 6Cl 2 \u003d C 6 H 6 Cl 6 + 6HCl (állapot - UV sugárzás).
A klór fizikai tulajdonságai
A klór sárgászöld gáz. Hőstabil. Amikor a lehűtött vizet klórral telítjük, szilárd klarát képződik. Vízben jól oldódik, nagymértékben dezmutáción megy keresztül ("klórvíz"). Szén-tetrakloridban, folyékony SiCl 4 -ben és TiCl 4 -ben oldódik. Telített nátrium-klorid-oldatban rosszul oldódik. Oxigénnel nem reagál. Erős oxidálószer. Forráspont - -34,1 C, olvadáspont - -101,03 C.
Klór beszerzése
Korábban a klórt a Scheele-módszerrel (a mangán (VI)-oxid reakciója sósavval) vagy a Deacon-módszerrel (hidrogén-klorid és oxigén kölcsönhatásának reakciója) nyerték:
MnO 2 + 4HCl \u003d MnCl 2 + Cl 2 + 2H 2 O;
4HCl + O 2 \u003d 2H 2 O + 2 Cl 2.
Korunkban a következő reakciókat alkalmazzák a klór előállítására:
NaOCl + 2HCl = NaCl + Cl 2 + H 2 O;
2KMnO4 + 16HCl = 2KCl + 2MnCl2 +5 Cl2 + 8H2O;
2NaCl + 2H 2 O \u003d 2NaOH + Cl 2 + H 2 (állapot - elektrolízis).
Klór alkalmazása
A klórt széles körben alkalmazzák különféle iparágakban, mivel a klór előállításához használják polimer anyagok(polivinil-klorid), fehérítők, szerves klórtartalmú rovarirtó szerek (hexachloran), vegyi harci szerek (foszgén), vízfertőtlenítésre, élelmiszeriparban, kohászatban stb.
Példák problémamegoldásra
1. PÉLDA
2. PÉLDA
| A feladat | Mekkora térfogatú, tömegű és mennyiségű klóranyag szabadul fel (n.o.) 17,4 g mangán (IV)-oxid és sósav kölcsönhatása során, feleslegben? |
| Megoldás | Írjuk fel a mangán (IV)-oxid és sósav kölcsönhatásának reakcióegyenletét: 4HCl + MnO 2 \u003d MnCl 2 + Cl 2 + 2H 2 O. A mangán (IV)-oxid és a klór móltömegei a D.I. kémiai elemeinek táblázatával számítva. Mengyelejev - 87 és 71 g/mol. Számítsa ki a mangán (IV) oxid anyag mennyiségét: n(Mn02) = m(MnO2)/M(MnO2); n (MnO 2) \u003d 17,4 / 87 \u003d 0,2 mol. Az n (MnO 2) reakcióegyenlet szerint n (Cl 2) \u003d 1:1, tehát n (Cl 2) \u003d n (MnO 2) \u003d 0,2 mol. Ekkor a klór tömege és térfogata egyenlő lesz: m(Cl 2) = 0,2 × 71 = 14,2 g; V (Cl 2) \u003d n (Cl 2) × V m = 0,2 × 22,4 \u003d 4,48 l. |
| Válasz | A klóranyag mennyisége 0,2 mol, tömege 14,2 g, térfogata 4,48 l. |
D. I. Mengyelejev periódusos rendszerének alcsoportjának VII. Külső szinten - 7 elektron, ezért a redukálószerekkel való kölcsönhatás során a klór megmutatja oxidáló tulajdonságait, és fémelektront vonz magához.
A klór fizikai tulajdonságai.
A klór sárga gáz. Szúrós szaga van.
A klór kémiai tulajdonságai.
Ingyenes klór nagyon aktív. Az oxigén, a nitrogén és a nemesgázok kivételével minden egyszerű anyaggal reagál:
Si + 2 Cl 2 = SiCl 4 + K.
Ha szobahőmérsékleten hidrogénnel kölcsönhatásba lép, gyakorlatilag nincs reakció, de amint a megvilágítás külső hatásként hat, láncreakció lép fel, amely a szerves kémiában is alkalmazható.
Melegítéskor a klór képes kiszorítani a jódot vagy a brómot a savakból:
Cl 2 + 2 HBr = 2 HCl + Br 2 .
A klór reagál a vízzel, részben feloldódik benne. Ezt a keveréket klórvíznek nevezik.
Lúgokkal reagál:
Cl 2 + 2NaOH \u003d NaCl + NaClO + H 2 O (hideg),
Cl 2 + 6KOH = 5KCl + KClO 3 + 3 H 2 O (hőség).
Klór beszerzése.
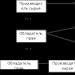
1. Nátrium-klorid olvadék elektrolízise, amely a következő séma szerint megy végbe:
2. Laboratóriumi módszer klór előállítására:
MnO 2 + 4HCl \u003d MnCl 2 + Cl 2 + 2H 2 O.
Cl 2, vol. T - sárga-zöld gáz éles fullasztó szaggal, nehezebb a levegőnél - 2,5-szer, vízben enyhén oldódik (~ 6,5 g / l); X. R. nem poláris szerves oldószerekben. Csak vulkáni gázokban található szabadon.
Hogyan lehet eljutni
Az anionok oxidációs folyamata alapján Cl -
2Cl - - 2e - = Cl 2 0
Ipari
Kloridok vizes oldatainak elektrolízise, gyakrabban - NaCl:
2NaCl + 2H 2 O \u003d Cl 2 + 2NaOH + H 2
Laboratórium
Oxidációs konc. HCI különböző oxidálószerek:
4HCI + MnO 2 \u003d Cl 2 + MpCl 2 + 2H 2 O
16HCl + 2KMnO 4 \u003d 5Cl 2 + 2MnCl 2 + 2KCl + 8H 2 O
6HCl + KClO 3 \u003d ZCl 2 + KCl + 3H 2 O
14HCl + K 2 Cr 2 O 7 \u003d 3Cl 2 + 2CrCl 3 + 2KCl + 7H 2 O
Kémiai tulajdonságok
A klór nagyon erős oxidálószer. Oxidálja a fémeket, nemfémeket és összetett anyagokat, miközben nagyon stabil anionokká alakítja Cl -:
Cl 2 0 + 2e - \u003d 2Cl -
Reakciók fémekkel
Az aktív fémek száraz klórgáz légkörében meggyulladnak és égnek; ilyenkor fémkloridok keletkeznek.
Cl 2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
Az inaktív fémek könnyebben oxidálódnak nedves klórral vagy annak vizes oldataival:
Cl 2 + Cu \u003d CuCl 2
3Cl 2 + 2Au = 2AuCl 3
Reakciók nem fémekkel
A klór nem csak O 2-vel, N 2-vel, C-vel lép kölcsönhatásba közvetlenül. A reakciók más nemfémekkel különböző körülmények között mennek végbe.
Nemfém-halogenidek képződnek. A legfontosabb a hidrogénnel való kölcsönhatás reakciója.
Cl 2 + H 2 \u003d 2HC1
Cl 2 + 2S (olvadék) = S 2 Cl 2
ЗCl 2 + 2Р = 2РCl 3 (vagy РCl 5 - Cl 2 felett)
2Cl 2 + Si = SiCl 4
3Cl 2 + I 2 \u003d 2ICl 3
A szabad nemfémek (Br 2, I 2, N 2, S) kiszorítása vegyületeikből
Cl 2 + 2KBr = Br 2 + 2KCl
Cl 2 + 2KI \u003d I 2 + 2KCl
Cl 2 + 2HI \u003d I 2 + 2HCl
Cl 2 + H 2 S \u003d S + 2HCl
ZCl 2 + 2NH 3 \u003d N 2 + 6HCl
Klór aránytalanítása vízben és lúgok vizes oldatában
Az önoxidáció-öngyógyulás eredményeként a klóratomok egy része Cl - anionokká alakul, míg mások pozitív oxidációs állapotban a ClO - vagy ClO 3 - anionok részei.
Cl 2 + H 2 O \u003d HCl + HClO hipoklóros to-ta
Cl 2 + 2KOH \u003d KCl + KClO + H 2 O
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O
3Cl 2 + 2Ca (OH) 2 \u003d CaCl 2 + Ca (ClO) 2 + 2H 2 O
Ezek a reakciók fontosságát, mivel ezek a klór oxigénvegyületeinek termeléséhez vezetnek:
KClO 3 és Ca (ClO) 2 - hipokloritok; KClO 3 - kálium-klorát (bertolet-só).
A klór kölcsönhatása szerves anyagokkal
a) hidrogénatomok helyettesítése az OB molekulákban
b) Cl 2 molekulák kapcsolódása a többszörös szén-szén kötés felszakadásának pontján
H 2 C \u003d CH 2 + Cl 2 → ClH 2 C-CH 2 Cl 1,2-diklór-etán
HC≡CH + 2Cl 2 → Cl 2 HC-CHCl 2 1,1,2,2-tetraklór-etán
Hidrogén-klorid és sósav
Hidrogén-klorid gáz
Fizikai és kémiai tulajdonságok
A HCl egy hidrogén-klorid. Rev. T - színtelen. szúrós szagú gáz, meglehetősen könnyen cseppfolyósodik (olvadáspont -114°С, fp. -85°С). A vízmentes HCl gáz- és folyékony halmazállapotban sem vezetőképes, kémiailag közömbös a fémekkel, fémoxidokkal és -hidroxidokkal, valamint sok más anyaggal szemben. Ez azt jelenti, hogy víz hiányában a hidrogén-klorid nem mutat savas tulajdonságokat. A gázhalmazállapotú HCl csak nagyon magas hőmérsékleten lép reakcióba fémekkel, még az olyan inaktívakkal is, mint a Cu és az Ag.
A sósavban lévő klorid-anion redukáló tulajdonságai is kismértékben megnyilvánulnak: térfogatban fluor oxidálja. T, valamint magas T (600°C) mellett katalizátorok jelenlétében reverzibilisen reagál oxigénnel:
2HCl + F 2 \u003d Cl 2 + 2HF
4HCl + O 2 \u003d 2Cl 2 + 2H 2 O
A gáznemű HCl-t széles körben használják szerves szintézisben (hidroklórozási reakciók).
Hogyan lehet eljutni
1. Szintézis egyszerű anyagokból:
H 2 + Cl 2 \u003d 2HCl
2. Szénhidrogén-klórozás során melléktermékként keletkezik:
R-H + Cl 2 = R-Cl + HCl
3. A laboratóriumban megkapják a konc. H 2 SO 4 kloridokhoz:
H 2 SO 4 (tömény) + NaCl \u003d 2HCl + NaHSO 4 (alacsony fűtéssel)
H 2 SO 4 (tömény) + 2NaCl \u003d 2HCl + Na 2 SO 4 (nagyon erős melegítéssel)
A HCl vizes oldata erős sav (sósav vagy sósav)
A HCl vízben nagyon jól oldódik: térfogatnál T 1 l H 2 O-ban ~ 450 l gázt old fel (az oldódás jelentős mennyiségű hő felszabadulásával jár). Egy telített oldatban a HCl tömeghányada 36-37%. Ennek az oldatnak nagyon csípős, fullasztó szaga van.
A vízben lévő HCl molekulák szinte teljesen ionokra bomlanak, azaz a HCl vizes oldata erős sav.
A sósav kémiai tulajdonságai
1. A vízben oldott HCl a savakra jellemző összes általános tulajdonsággal rendelkezik a H + ionok jelenlétének köszönhetően
HCl → H + + Cl -
Kölcsönhatás:
a) fémekkel (H-ig):
2HCl 2 + Zn \u003d ZnCl 2 + H 2
b) bázikus és amfoter oxidokkal:
2HCl + CuO \u003d CuCl 2 + H 2 O
6HCl + Al 2 O 3 \u003d 2AlCl 3 + ZN 2 O
c) bázisokkal és amfoter hidroxidokkal:
2HCl + Ca (OH) 2 \u003d CaCl 2 + 2H 2 O
3HCl + Al(OH) 3 \u003d AlCl 3 + ZN 2 O
d) gyengébb savak sóival:
2HCl + CaCO 3 \u003d CaCl 2 + CO 2 + H 3 O
HCl + C 6 H 5 ONa \u003d C 6 H 5 OH + NaCl
e) ammóniával:
HCl + NH 3 \u003d NH 4 Cl
Reakciók erős oxidálószerekkel F 2 , MnO 2 , KMnO 4 , KClO 3 , K 2 Cr 2 O 7 . Anion Cl - szabad halogénné oxidálódik:
2Cl - - 2e - = Cl 2 0
A reakcióegyenletekért lásd a „Klór beszerzése” című részt. A sósav és a salétromsav közötti OVR különösen fontos:

Reakciók szerves vegyületekkel
Kölcsönhatás:
a) aminokkal (mint szerves bázisokkal)
R-NH 2 + HCl → + Cl -
b) aminosavakkal (amfoter vegyületekként)

Klór oxidjai és oxosavai
Savas oxidok

savak

só
Kémiai tulajdonságok
1. A klór minden oxosavja és sói erős oxidálószer.
2. A molekulán belüli oxidáció-redukció vagy aránytalanság következtében melegítés hatására szinte minden vegyület lebomlik.

Fehérítő por
A klór (fehérítő) mész - hipoklorit és kalcium-klorid keveréke, fehérítő és fertőtlenítő hatású. Néha egy vegyes só példájának tekintik, amely egyidejűleg két sav anionjait tartalmazza:

Javel víz
Klorid és kálium-hapoklorit vizes oldata KCl + KClO + H 2 O